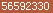疾病控制率,我国自主研发广谱新药
2020-7-30 来源:本站原创 浏览次数:次北京白癜风医院地址 http://wapyyk.39.net/bj/zhuanke/89ac7.html
EGFR全称表皮生长因子受体,属于表皮生长因子受体(HER)家族。EGFR是一类泛癌种的致癌基因,可能导致多种癌症类型。相关研究认为,约30%的上皮来源肿瘤与EGFR或其家族成员的突变、扩增或失调有关。由于这样的特点,针对EGFR靶点的药物研究数量较多,覆盖患者群体丰富。对于许多癌症患者来说,发现EGFR突变都有着至关重要的意义,意味着患者有更多“特效药”可供选择,有望获得更长的生存期与更好的生活质量。
但在EGFR突变中,有一类比较罕见的突变类型,对于各类EGFR-TKI药物均不敏感,患者治疗难度很大,靶向药物的使用仍然存在不小的尴尬。已有药物疗效欠佳、外国在研药物又难以获得,患者的生存质量仍需提高。
幸运的是,针对EGFR20号外显子插入突变这一突变类型,许多新药试验均在如火如荼地进行当中,有望为此类患者提供可行选择。
开云见霁,我国创新药物JMT-投入试验!
年,我国自主研发的、专门针对EGFRex20in患者的新药JMT-已经获得批准投入临床试验,以多种实体瘤为目标,向癌症发起挑战。
在年ASCO线上会议中,一项使用我国自主研发的、针对多种实体瘤的人源化EGFR单克隆抗体创新药物JMT-治疗晚期大肠癌患者的试验结果首次公开,疾病控制率达到%,令人瞩目。
ASCO:客观缓解率57.1%,疾病控制率%!
Ⅰ期试验主要检验JMT-的安全性和耐受性,同时观察疗效及药代动力学情况。试验共23例可评估疗效的患者,均为曾接受过ACC且未接受过系统EGFR靶向治疗的晚期大肠癌患者。其中16例患者接受JMT-单药治疗,7例患者接受JMT-联合mFOLFOX6或FOLFIRI方案共同治疗。
在JMT-单药治疗组、联合mFOLFOX6治疗组及联合FOLFIRI治疗组中,JMT-的应用剂量分别达到10.0、8.0和6.0mg/kg。
其结果显示,接受JMT-单药治疗的患者客观缓解率为12.5%,疾病控制率为56.2%;接受联合治疗的患者,客观缓解率为57.1%,疾病控制率达到%,疾病控制时间超过24周。
在不良反应方面,未观察到剂量限值毒性,未达到最大耐受剂量,且未观察到与治疗相关的严重不良反应。最常见的不良事件包括皮疹(单药组81.3%,联合组%)、蛋白尿(单药组62.5%,联合组28.6%)和口腔黏膜溃疡(联合组86.0%)。
整体来说,通过Ⅰ期试验观察到,JMT-具有良好的安全性、患者耐受性及抗肿瘤活性。
免费用药机会来了!JMT-治疗非小细胞肺癌临床招募进行中
目前JMT-治疗多种实体瘤的Ⅰ期临床试验已经陆续开始。其中,治疗非小细胞肺癌的Ⅰb期试验正在招募患者。
试验名称:评价JMT联合阿法替尼或奥希替尼治疗EGFR20号外显子插入突变的ⅢB或Ⅳ期非小细胞肺癌患者的安全性和有效性的Ⅰb期临床研究
试验分期:Ⅰb期
主要纳入标准:
1、年龄18~75(含)周岁,性别不限;
2、ⅢB或Ⅳ期非小细胞肺癌,不适合进行根治性手术或放疗,且证实具有EGFR20号外显子插入突变(包括重复突变),初治或一线治疗失败后的患者;
3、基线至少存在一个符合RECIST1.1标准定义的可测量的病灶;
4、ECOG体能状态评分:0或1分;
5、预计生存时间≥3个月等。
主要排除标准:
1、既往接受过EGFR单克隆抗体靶向治疗;
2、具有临床症状的中枢神经系统转移或脑膜转移;
3、在首次使用研究药物前4周内接受过其他治疗方案等。
申请流程:
1、按要求将病历资料提交至全球肿瘤医生网医学部;
2、医学部初步评估后匹配合适的临床试验;
3、向相应的试验中心提交病历资料;
4、评估通过后协助患者参加临床试验。
申请方式:
做过基因检测的病友,请将报告发送至全球肿瘤医生网医学部,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
1、请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang
globecancer.
 健康热线:
健康热线: